Meeting Summary
El tercer Encuentro Latinoamericano de Infecciones Respiratorias Recurrentes (ELAIR) tuvo lugar en Ciudad de México, México, los días 11 y 12 de mayo de 2017. ELAIR reunió a expertos de toda Latinoamérica y otros países, continuando con un extraordinario ejercicio didáctico en cuanto a los vanguardistas avances de la medicina respiratoria. En los últimos 15 años se ha realizado un progreso espectacular, gracias a la aparición de nuevos tratamientos disponibles para gestionar y evitar infecciones en las vías respiratorias. Queda por ver cómo podría afectar todo esto a dolencias relacionadas como las sibilancias y el asma, en los sujetos predispuestos e hipersensibles. No obstante, los primeros datos sugieren que, tasas más bajas de infección en las vías respiratorias, podrían reducir el desarrollo de las condiciones antes mencionadas, estrechamente relacionadas con las infecciones víricas. Es probable que los inmunorreguladores que preparan el sistema inmunológico para combatir la infección y que, además, reducen la inflamación, jueguen un papel fundamental en la prevención secundaria (e incluso potencialmente primaria) de las enfermedades atópicas.
RESISTENCIA ANTIMICROBIANA: UNA AMENAZA MUNDIAL
La crisis de la resistencia antimicrobiana (RAM) mundial se agrava. El persistente empeoramiento de la situación en los últimos años ofrece una perspectiva pesimista sobre cualquier resumen del estado de las cosas. Sin embargo, a través de esta perspectiva podemos ganar claridad, permitiendo a la comunidad médica atacar el problema con nuevas ideas y estrategias.
Pocos ejemplos pueden ilustrar mejor el panorama radicalmente alterado en la atención de las enfermedades infecciosas, que la comparación de un caso del comienzo de la era de los antibióticos, con otro del presente. En un estudio fundacional, Abraham y cols.1 se presentó el caso de un niño de 4 años de edad que fue uno de los primeros pacientes en el mundo tratados con penicilina. El paciente presentaba una trombosis del seno cavernoso, secundaria al pioderma de los párpados, una típica complicación posterior al sarampión, causada por una superinfección bacteriana provocada por Staphylococcus aureus. La infección resultó resistente a la terapia con sulfapiridina y, hasta el momento de la admisión hospitalaria, el niño estaba semicomatoso, con incontinencia de orina y heces, con un edema grueso en ambos párpados, proptosis bilateral, oftalmoplegia externa bilateral completa y rigidez en la nuca. Padecía meningoencefalitis debido a la infección estafilocócica masiva. Tras el tratamiento intravenoso (IV) con penicilina, el niño mejoró rápidamente y, después de 2 semanas, el líquido cefalorraquídeo se había vuelto estéril.1
Sesenta y siete años después, un hombre de 70 años de edad desarrolló endocarditis mitral con una infección por Enterococcus faecium resistente a la vancomicina, después de un procedimiento de Whipple para tratar un tumor pancreático. Mostró una bacteremia persistente después de 12 días de tratamiento con linezolida. Se cambió la terapia a daptomicina (6 mg/kg/48 horas) sin ningún efecto; el día 17, se aumentó la dosis de daptomicina hasta 8 mg/kg/48 horas, y se añadieron doxiciclina y gentamicina. Diez días después, los hemocultivos siguieron dando positivo para E. faecium (concentración inhibitoria mínima de daptomicina: [CIM]: 2 mg/l). Se cambió la terapia a quinupristina/dalfopristina (CIM: 0,5 mg/L); sin embargo, el paciente murió el día 33 de tratamiento con hemocultivos positivos.2 Estos casos de infección bacteriana grave, resistentes a todos los antimicrobianos disponibles, se pueden encontrar hoy en día en todos los hospitales del mundo.
En 1992, el especialista en enfermedades infecciosas de EE. UU. Harold Neu, publicó un estudio advirtiendo sobre la complacencia con respecto a la RAM.3 Neu señaló que, a día de hoy, muchas especies bacterianas eran resistentes a la gran mayoría de los antibióticos antiguos. Destacó el uso excesivo de antibióticos, tanto en hospitales como por el público en general, como origen del problema, y pidió programas de control de antibióticos, mejoras en la higiene, e investigaciones para sintetizar nuevas sustancias para reducir la resistencia adicional, y para evitar una crisis de RAM mundial. Veinticinco años después, a pesar de la publicación de cientos de trabajos de investigación sobre el tema, y de numerosas iniciativas nacionales, la sociedad no ha logrado desvincularse del uso irresponsable de antibióticos, y la crisis predicha por Neu se ha hecho realidad. Sin embargo, recientemente, la gravedad de la amenaza ha comenzado a aunar desde iniciativas locales, hasta acciones mundiales.
El informe mundial de 2014 sobre la RAM de la Organización Mundial de la Salud (OMS)4 es el primer intento para crear una perspectiva mundial sobre el control de la RAM. El informe identificó importantes lagunas en el control, caracterizando a la RAM como una amenaza para los logros de la medicina moderna en su conjunto, y predijo la llegada de la era post-antibiótica si no se lograba un cambio en la dirección. La OMS solicitó a los gobiernos que mejoraran el control, para permitir un completo entendimiento de la magnitud de la RAM como primer paso para abordar el problema. El informe indicaba: “Una era posterior a los antibióticos, en la que las infecciones comunes y heridas menores pueden matar, más allá de ser una fantasía apocalíptica, es una posibilidad muy real del siglo 21.”4 Esta afirmación se ilustra claramente por la detección de Escherichia coli resistente a la tercera generación de cefalosporinas o fluoroquinolonas, y de Staphylococcus aureus resistente a la meticilina (SARM), en cinco de las seis regiones mundiales de la OMS (América, Europa, África, el Mediterráneo oriental, Asia Sudoriental, y el Pacífico Oeste), así como de Klebsiella pneumoniae resistente a múltiples fármacos (RMF), en todas las regiones del mundo.4
Una publicación de entidad del gobierno del Reino Unido predijo un aumento en las muertes atribuidas a la RAM, partiendo de una baja estimación de 700.000/año en 2014, a un potencial de 10 millones/año en 2050, si la crisis de resistencia no se gestiona; estas estadísticas indican que, las muertes relacionadas con la RAM, eclipsarán las provocadas por cáncer. Este número puede parecer exagerado pero, en realidad, esta basado en la resistencia de solo tres organismos: (K. pneumonia, E. coli, y S aureus), lo que sugiere que es una estimación muy conservadora del posible impacto de una resistencia sin freno.5
LA EPIDEMIOLOGÍA DE LOS ORGANISMOS RESISTENTES
La RAM puede encontrarse virtualmente en todas las formas de microorganismos conocidos, incluyendo virus (Varicella zoster [chicken pox/shingles]), protozoos (Plasmodium sp. [malaria]), hongos, y bacterias. El factor que con mayor trascendencia influye en la RAM, es la exposición de un organismo a la presión de selección de un compuesto antimicrobiano. El estado actual de la RAM ha llevado a la RMF a trasladarse del hospital a la comunidad, y es posible encontrar infecciones adquiridas en comunidad mediante organismos RMF en todo el mundo.
Centrándose en las especies bacterianas, los organismos de mayor importancia en pacientes hospitalizados son los pneumococos RMF, SARM, y enterococos resistentes a la vancomicina, entre los Gram-positivos. Entre las bacterias Gram-negativas, los bacilos que expresan β-lactamasas de amplio espectro (ESBL), la Klebsiella sp. resistente a carbapenem y otras enterobacterias, Pseudomonas aeruginosa RMF, y Acinetobacter baumannii RMF, son las que más preocupan. Los bacilos Gram-negativos son los organismos que más preocupan debido a su batería de mecanismos de defensa contra los compuestos antimicrobianos. Las Gram-positivas RMF se encuentran ahora en la comunidad y en los animales que los hospedan, provocando infecciones adquiridas en comunidad, así como infecciones hospitalarias. Los primeros organismos panresistentes son miembros de este grupo, y se examinarán más adelante.
Streptococcus pneumoniae es el patógeno más importante de infecciones de las vías respiratorias (ITR) adquiridas en comunidad. En un estudio de 2014 en Seúl, Corea del Sur, se identificaron cinco cepas de neumococo que solo eran susceptibles a los antibióticos reservados para infecciones muy resistentes (linezolida, tigeciclina y vancomicina).6 En México, es evidente una erosión gradual de la susceptibilidad del S. pneumoniae a la clase de antibióticos macrólidos en las comparaciones de los datos de 2005-2007 con los de 2008-2012. Este grupo de antimicrobianos es particularmente importante para los pediatras, y la prevalencia actual de la resistencia (30–40 %), impide su uso como terapia empírica en México.7
Los enterococos, más comúnmente, Enterococcus faecalis, se están convirtiendo en infecciones adquiridas en el hospital cada vez más frecuentes. En Europa, el 90 % de los aislados de E. faecalis son susceptibles a la vancomicina; sin embargo, en Canadá, Hispanoamérica, y los EE. UU., se han detectado prevalencias de resistencia del 22 %, 28 %, y 79 % respectivamente.8
El SARM representa >25 % de aislados de S. aureus encontrados en la mayoría de los países europeos meridionales (Figura 1). La mayoría de los países centroeuropeos y nórdicos tienen una prevalencia de SARM >10 %, con menor resistencia, generalmente limitada a los países escandinavos y los Países Bajos.9
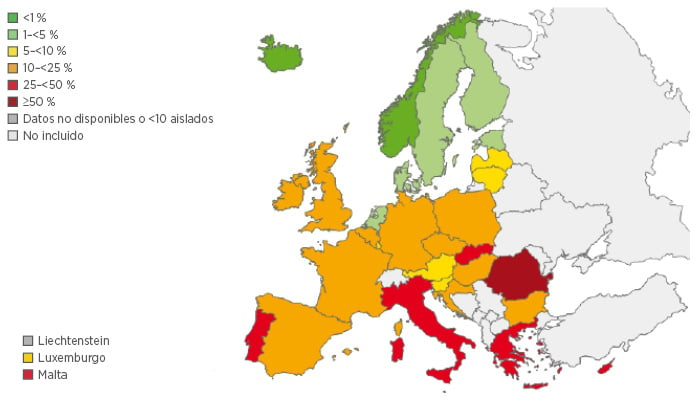
Figura 1: Porcentaje de aislados de SARM en los países participantes en 2013.9
SARM: Staphylococcus aureus resistente a la meticilina.
De las enterobacterias, en particular, la E. coli, es la bacteria Gram-negativa más común encontrada en hospitales. La presión de selección ejercida por los antibióticos, ha impulsado la evolución de las enzimas β-lactamasa hidrolizantes creando ESBL capaz de destruir cefalosporinas y carbapenemasas. La prevalencia mundial de E. coli productora de ESBL ha aumentado durante la última década, con los mayores niveles observados en las regiones de Asia y el Pacífico (28 %) e Hispanoamérica (23 %), según las cifras de 2009−2010.10 En la K. pneumoniae, la prevalencia de la productora de ESBL ha demostrado una tendencia al alza similar, con cifras de 2008-2010 que superan el 50% en Hispanoamérica (53 %).10 En los EE. UU., la prevalencia nacional de la productora de ESBL fue del 12 % en un estudio que examinaba cuatro especies de enterobacterias; sin embargo, existen variaciones regionales importantes, con una prevalencia de hasta el 23 % en la región del Atlántico Medio, y de tan solo el 4 % en la región del oeste-norte-centro. Además, muchas de las cepas expresaron más que un gen para la producción de ESBL, estableciendo múltiples rutas de resistencia.11 Cientos de variantes de β-lactamasa están a día de hoy presentes en todo el mundo, y el ser humano es, a nivel mundial, un portador de organismos productores de ESBL cada vez mayor.12
A pesar de su estado relativamente protegido, los carbapenems se han utilizado libremente en pacientes inmunodeprimidos en todo el mundo. En algunos países europeos, como Italia y Grecia, las enterobacterias productoras de carbapenemasas son endémicas. Incluso en los Países Bajos, donde el uso de antimicrobianos es extremadamente estricto y que cuentan con programas de búsqueda y destrucción dirigidos a organismos resistentes, no pueden evitar las ESBL. Los datos indican que se han producido en hospitales brotes individuales de enterobacterias productoras de carbapenemasas; basándose en la tendencia actual, es probable que empeore la situación.13
La resistencia a la colistina mediada por plásmidos (MCR-1) es la amenaza más reciente. La colistina polimixina se lleva comercializando desde la década de los 60, pero se ha evitado debido a su toxicidad y poca penetración. Sin embargo, sigue siendo muy activa contra las bacterias Gram-negativas, y se ha convertido en el último recurso antibiótico contra muchas infecciones por RMF. El grado en el que el gen mcr-1 se ha diseminado entre las enterobacterias queda por determinar; sin embargo, se han notificado dos casos de bacteremia causada por E. coli productora de MCR-1 en Suiza. Ninguno de los pacientes había recibido tratamiento previo con polimixinas, viajado al exterior en los últimos años ni había estado expuesto a animales de granja. Estos datos sugieren una diseminación silenciosa y horizontal del plásmido del gen mcr-1 en E. coli adquirida en la comunidad, con el potencial de consecuencias desastrosas.14
Para muchos, la tuberculosis es una infección asociada con el siglo 19 en lugar del siglo 21; sin embargo, la tuberculosis RMF, resistente a la isoniazida o la rifampicina, está presente en todos los países del mundo. Además, muchos países han tenido al menos un caso de tuberculosis muy resistente a los medicamentos, que tiene pocas opciones de tratamiento, y es probable que una vigilancia deficiente sea una de las causas de su menor notificación generalizada.4
CONSUMO DE ANTIBIÓTICOS
La RAM es un ejemplo elegante de la selección natural en el trabajo. Las mutaciones aleatorias que confieren resistencia son ventajosas para bacterias expuestas a la presión selectiva de antimicrobianos producidos naturalmente en el medio ambiente. Sin embargo, esta selección natural se ha acelerado rápidamente por el abuso de los antibióticos durante el siglo 20. El uso excesivo no se limita a la medicina, sino que es un problema importante en la producción de carne, lo que lleva a la resistencia directa, así como el consumo posterior por los seres humanos. El uso indebido va más allá de lo que es el uso en infecciones no bacterianas, a dosis inadecuadas o con duraciones de tratamiento que favorecen la supervivencia de bacterias resistentes.
El uso de antimicrobianos es común fuera de la medicina humana; de hecho, aproximadamente el 80 % del uso anual de antimicrobianos en los EE. UU. se realiza en ganadería, agricultura y acuicultura.15 China usa más antibióticos que cualquier otro país; un estudio de 2007 estimó que se utilizaron 210 millones de kg de antibióticos, utilizándose >46 % de estos medicamentos en producción agropecuaria.16 China, junto con la India, es el principal consumidor de antimicrobianos y, por lo tanto, el principal productor de microorganismos RFM. Los datos sobre E. coli productora de ESBL en las heces de gallinas, cerdos y ganado vacuno de Hong Kong muestran un aumento constante en las tres especies. En 2013, el 70–80 % de cerdos y gallinas y, aproximadamente, el 45 % de las vacas evaluadas, tenían flora intestinal resistente.17 No existen estudios que ilustren estas relaciones directamente; sin embargo, puede entenderse de manera intuitiva la relación entre el consumo de productos animales tratados con antimicrobianos y la RAM en humanos.
A nivel mundial, el consumo de antimicrobianos aumentó en un 40 % entre 2000−2010; sin embargo, este patrón esconde una imagen variada de consumo reducido en algunos países, y grandes aumentos en otros. El consumo anual varía en torno a una magnitud de diez en todos los países de renta media y alta. Las economías de Brasil, Rusia, India, y China, junto con Sudáfrica, fueron responsables de la gran mayoría del crecimiento entre 2000−2010.18
La relación entre el consumo directo de antimicrobianos humanos y la RAM se ha demostrado en Europa, donde existe un sistema de vigilancia. Existe un amplio rango de consumo de aproximadamente 10 dosis diarias definidas por cada 1.000 habitantes por día en países como Estonia y los Países Bajos, y cerca de 40 dosis diarias definidas por cada 1.000 habitantes por día en Grecia.19,20 Los países que consumen grandes cantidades de antibióticos, como Grecia e Italia, como era de esperar, tienden a tener la mayor prevalencia de resistencia.
RESISTENCIA A NEUMOCOCOS
Definimos la resistencia de un microorganismo a un antimicrobiano específico basado en la CIM como la concentración más baja que inhibe visiblemente el crecimiento bacteriano durante la noche. Las CIM cambian con el tiempo, y una serie de organizaciones específicas en Europa las calculan y publican, incluyendo la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID), y el Instituto de Estándares Clínicos y de Laboratorio (CSLI) en EE. UU.
S. pneumoniae es la causa más común de ITR adquiridas provocadas por bacterias. En México, la susceptibilidad del S. pneumoniae a los antibióticos analizados disminuyó al comparar los datos para 2005–2007 y 2008–2012 del ensayo T.E.S.T ampliado.7 En muchos casos, cuando una cepa bacteriana desarrolla resistencia a un solo antibiótico dentro de una clase, por ejemplo, a través de la producción de β-lactamasa, el mecanismo establecerá resistencia a todos los antibióticos dentro de esta clase.
Las opciones de tratamiento comunes para la ITR adquirida en la comunidad incluyen trimetoprima/sulfametoxazol, tetraciclinas, cloranfenicol, macrólidos/azálidos/cetólidos, β-lactamasa y fluoroquinolonas. Los macrólidos, β-lactámicos y fluoroquinolonas son quizás los más comúnmente utilizados, y los consiguientes mecanismos de resistencia son bien conocidos.
S. pneumoniae: resistencia a los macrólidos
Los macrólidos han estado disponibles desde la década de los años 50, y se han usado con frecuencia contra los neumococos, particularmente en la población pediátrica, debido a su perfil de seguridad y eficacia. Los macrólidos son inhibidores de la síntesis de proteínas, dirigidos tanto a la traducción de peptidiltransferasa como a la traducción ribosomal. Por lo tanto, el macrólido debe alcanzar una concentración citoplásmica suficiente para tener efecto, y los neumococos pueden volverse resistentes expresando bombas de eflujo (genes mefA o mefE) para expulsar el antibiótico. Un segundo mecanismo de resistencia más complejo y eficiente implica a la metilasa ribosomal (el gen ermB o, raramente, el gen ermA), que dimetila el ARN ribosomal 23S neumocócico, impidiendo el acceso al sitio de unión del antibiótico. Se han descrito otras mutaciones que afectan la unión de los macrólidos a las proteínas ribosomales L4 y L22.
Las infecciones neumocócicas han demostrado la capacidad de adquirir resistencia in vivo. Una carta publicada en 2002 presenta un ejemplo trágico de resistencia a los macrólidos relacionada con el tratamiento. Un hombre de 28 años había cursado con una historia de tos y disnea de 5 días; el cultivo de esputo reveló una infección por S. pneumoniae. Se inició el tratamiento con 500 mg/día de azitromicina por vía intravenosa, y el paciente respondió bien; sin embargo, en el día 4 comenzó a mostrar insuficiencia respiratoria progresiva y se trasladó a cuidados intensivos. A pesar de la administración de ceftriaxona y vancomicina, el paciente desarrolló insuficiencia multiorgánica y murió. Los aislados de S. pneumoniae tomados después del deterioro del paciente mostraron los mismos marcadores genéticos (patrones de tipificación BOX) que el cultivo inicial, lo que indica que era la misma cepa. Sin embargo, aunque los aislados iniciales mostraron susceptibilidad total a todos los antibióticos analizados, incluida la penicilina, el segundo aislado se volvió resistente a la eritromicina, la azitromicina y la quinupristina/dalfopristina. La secuenciación reveló que la resistencia se estableció por una mutación de la proteína ribosomal L22.21
Estos casos no son aislados. En el norte de África, el tracoma es una enfermedad endémica, y una de las principales causas de pérdida de visión durante la infancia. La OMS lleva a cabo programas en la región para prevenir el tracoma con una sola dosis de azitromicina. Durante uno de estos programas en Marruecos, un bebé de 2,5 meses portador nasofaríngeo de S. pneumoniae (serotipo 22F) desarrolló resistencia después de una dosis única del macrólidos. En este caso, la resistencia se adquirió por una mutación A>G en la posición 2059 del ARN ribosomal 23S, que resultó en una modificación de la CIM de 0,5 mg/l antes de la mutación a >256 mg/l después de la mutación.22
La resistencia a los macrólidos está aumentando en todo el mundo y, a menudo, se asocia con resistencia a la penicilina. Dos estudios recientes indican que la resistencia in vitro, a cualquier nivel, es un indicador del fracaso del tratamiento. El desarrollo de resistencia relacionada con el tratamiento no es un suceso aislado, por lo que se debe tener cuidado al recetar un solo macrólido a pacientes con infecciones neumocócicas extrameníngeas. La prevalencia de la resistencia determinará la necesidad de revaluar las recomendaciones actuales para el tratamiento de la infección adquirida en la comunidad.
S. pneumoniae: resistencia a β-lactama
S. pneumoniae reside en la nasofaringe y se encuentra exclusivamente en humanos. La bacteria adquiere su resistencia β-lactámicos por la transformación de material genético extraño de otros estreptococos. La transferencia de material genético a los genes que codifican proteínas de unión a penicilina, reduce su afinidad de unión a las β-lactamas, disminuyendo de ese modo la actividad de estos compuestos. A diferencia de otros mecanismos de resistencia, como la adquisición de una enzima hidrolizante, los cambios en las proteínas de unión a penicilina establecen aumentos graduales en la resistencia, ya que la capacidad del antibiótico para unirse y bloquear la formación de pared bacteriana se degrada por los cambios genéticos adquiridos gradualmente.
Sin un reservorio animal, la erradicación de S. pneumoniae parece una posibilidad. Sin embargo, la existencia de 93 serotipos de S. pneumoniae, su capacidad de pasar rápidamente entre individuos, y su capacidad para establecer RAM a través de la transformación de genes hacen de S. pneumoniae un organismo muy adaptable. Estas características hacen que las zonas de interacción humana de alta densidad, como las guarderías, se conviertan en fábricas de RAM, con niños que intercambian serotipos y bacterias, que a su vez intercambian genes de resistencia.
Los β-lactámicos actúan de manera tiempo dependiente. El principal parámetro farmacocinético/farmacodinámico que predice la erradicación es el momento en que la concentración del antibiótico en el suero está por encima de la CIM. Por lo tanto, para mejorar la erradicación, los intervalos de dosificación son más importantes que el aumento de la dosis. Por ejemplo, durante la normalización de la terapia con amoxicilina/clavunato el aumento en la dosis de amoxicilina de 500 mg a 875 mg resultó en un aumento en el tiempo por encima de la CIM del 36 % al 44 %, mientras que, un cambio en la dosis de dos a tres veces al día aumentó el tiempo por encima de la CIM del 36 % al 55 %.
La elección del antibiótico β-lactámico es también una consideración importante, particularmente en la población pediátrica. Entre las cefalosporinas orales, la cefuroxima y la cefpodoxima tienen la mayor actividad contra la S. pneumoniae susceptible a la penicilina. Sin embargo, su CIM es 1-4 diluciones superior que la amoxicilina contra cepas no susceptibles y provocan más daños colaterales que las penicilinas. Como resultado, cuando se trata oralmente una infección respiratoria por neumococo, la amoxicilina sigue siendo el β-lactámico con la mejor relación farmacocinética/ farmacodinamia, particularmente en niños, y con menor impacto en la flora residente. Las cefalosporinas orales, cefixima, cefaclor, ceftibuten y loracarbef, y los macrólidos, no se suelen recomendar debido a la disminución de la actividad de estos agentes contra los neumococos no susceptibles.23-25
Incluso en cepas resistentes a la penicilina, la dosis adecuada del β-lactámico correcto sigue siendo una terapia eficaz. No se han documentado fallos en el tratamiento con una dosificación adecuada de penicilinas o cefalosporinas de tercera generación en pacientes con infecciones extrameníngeas.26 No existe evidencia de una mayor mortalidad en la neumonía resistente a la penicilina cuando se ajusta por la gravedad de la enfermedad y la comorbilidad. Sin embargo, se ha notificado una mayor mortalidad por meningitis provocada por cepas no susceptibles a la penicilina.
S. pneumoniae: resistencia a la fluoroquinolona
Las fluoroquinolonas se convirtieron en parte del arsenal de tratamiento de neumococos en la década de los 80, con la introducción de la ciprofloxacina relativamente inactiva. Una gran cantidad de posibles compuestos posteriores de fluoroquinolona falló debido a problemas de toxicidad. Sin embargo, aquellas actualmente autorizadas, incluyendo levofloxacina y moxifloxacina, tienen una excelente actividad contra el neumococo.
El objetivo de las fluoroquinolonas son las enzimas ADN girasa y la topoisomerasa IV, que controlan el enrollado y desenrollado del genoma bacteriano necesario para la replicación. Los neumococos tienen varios mecanismos de resistencia contra las fluoroquinolonas; los más comunes implican mutaciones en los genes que codifican las enzimas diana. Las mutaciones ocurren con frecuencia en parC, que codifica la subunidad A de la ADN topoisomerasa IV, o gyrA, que codifica la subunidad A de la ADN girasa. Con menor frecuencia, se pueden encontrar mutaciones en los genes parE y gyrB, que codifican las subunidades B de estas proteínas. Las bombas de eflujo también desempeñan un papel en la disminución de la susceptibilidad, aunque estas son menos importantes para establecer resistencia. La adquisición de las mutaciones parC y gyrA establece una resistencia completa a las fluoroquinolonas.27,28
La posibilidad de que las cepas de S. pneumoniae posean un mecanismo de resistencia oculta, debido a la presencia de una mutación de parC o gyrA, crea problemas potenciales para la terapia con fluoroquinolonas. De hecho, al igual que con la terapia con macrólidos, existen ejemplos bien documentados de resistencia relacionada con el tratamiento durante la terapia con fluoroquinolonas.29-32 En todos los casos documentados actualmente, se ha detectado el emparejamiento de parC o gyrA, y las infecciones han mostrado un nivel asombroso de resistencia a la terapia con fluoroquinolonas.
La resistencia relacionada con el tratamiento es más común en pacientes inmunocomprometidos, debido a una respuesta inmune reducida, mayor tiempo de transporte y una mayor densidad de organismos. Los pacientes con mieloma, por ejemplo, pueden tener una mayor diversidad bacteriana que pacientes sanos con neumonía. Los pacientes con enfermedad pulmonar estructural también tienen un mayor riesgo emergente de resistencia a fluoroquinolona relacionada con el tratamiento.
Dado el riesgo de mutaciones ocultas de un solo gen, puede ser prudente evitar el uso de la monoterapia con fluoroquinolona en pacientes tratados con fluoroquinolonas durante los meses anteriores. Además, en pacientes con infección neumocócica grave documentada, provocada por cepas con una CIM de levofloxacino ≥1 μg/ml, las fluoroquinolonas deben evitarse o usarse en combinación.29,30,32,33
STAPHYLOCOCCUS AUREUS
El SARM es quizás la cepa más conocida de RMF. La meticilina fue el primer β-lactámico sintético sintetizado en respuesta a la resistencia a la penicilina en 1959. Un año después, los primeros aislados de SARM se cultivaron en laboratorios del RU. La infección por SARM adquirida en el hospital se detectó en Europa occidental, EE. UU. y Australia en la década siguiente. En la década de los 80, el SARM estaba ocupando titulares fuera de la comunidad médica, y se había documentado SARM adquirido en la comunidad. El final de la década de los 90 contempló la primera aparición de SARM resistente a la vancomicina;34 hoy en día, el SARM representa una epidemia mundial tanto en la comunidad como en el hospital. En el ensayo T.E.S.T, la prevalencia del SARM en México fue del 45 %.7
El tratamiento de las infecciones por SARM se ha basado tradicionalmente en glucopéptidos, principalmente vancomicina; sin embargo, ha habido una erosión progresiva de la CIM de vancomicina, y las terapias alternativas están adquiriendo importancia. La daptomicina es la alternativa mejor conocida, pero tiene algunas limitaciones, incluyendo no ser adecuados para las infecciones pulmonares debido a la neutralización por surfactante pulmonar, y la infección por bacterias en otras zonas que comienzan a mostrar una disminución de la susceptibilidad. Linezolid es otro antibiótico útil en pacientes con infecciones graves por SARM que no pueden tratarse con glucopéptidos; sin embargo, la toxicidad de la médula ósea limita su uso y la resistencia mediada por plásmidos representa una posible amenaza futura.
Los resultados para S. aureus sensible a la meticilina, tratada con vancomicina, son significativamente peores que para las infecciones por SARM.35 Otros problemas con la terapia con vancomicina son la escasa penetración tisular, una actividad bactericida lenta, dificultad para optimizar la dosis, el aumento gradual de la CIM (MIC creep) y la aparición de cepas con niveles variables de susceptibilidad a vancomicina, incluyendo S. aureus heterorresistente, S. aureus resistente a nivel intermedio y, S. aureus resistente a vancomicina.36 Algunos agentes nuevos para cocos Gram-positivos RMF, como SARM, son dos lipoglicopéptidos altamente activos, ritavancina, y dalbavancina, oxazolidinona, tedizolid y dos nuevas β-lactamas cefalosporinas: ceftobiprol y ceftarolina.
BACTERIAS GRAM-NEGATIVAS
Las bacterias Gram-negativas son más complejas que sus homólogas Gram-positivas, y tienen na extraordinaria capacidad de defensa y plasticidad contra los compuestos antimicrobianos. Entre los mecanismos se incluye la pérdida de porinas, que reduce la penetración de algunos antibióticos a través de la membrana celular, lo que establece resistencia a los β-lactamicos como el imipenem; la producción de β-lactamasas que hidrolizan antibióticos en el espacio periplásmico; la sobreexpresión de bombas de efusión transmembrana, que tienen los β-lactamicos, quinolonas, aminoglucósidos, antibióticos de tetraciclina y cloranfenicol como diana; los mecanismos de derivación metabólica, generalmente a través de una nueva enzima que circunvala la vía inhibida por el antibiótico; la mutación o modificación ribosomal que impide la unión de algunos antibióticos tipo tetraciclina y aminoglucósidos; mutaciones del sitio diana que afectan a las quinolonas al alterar la ADN girasa y la topoisomerasa IV; y enzimas que modifican e inactivan directamente los antibióticos como, por ejemplo, los aminoglucósidos y la ciprofloxacina.37 La presión de la selección de antibióticos ha impulsado la incidencia de mutaciones, dando lugar a mecanismos de resistencia tras la introducción de cada nueva clase de antibiótico tipo ampicilina en la década de los 60 (TEM, SHV serina, β-lactamasas), las cefalosporinas en la década de los 80 (β-lactamas tipo AcrAB, blaSHV, blaTEM, AmpC), y carbapenémicos de los años 1990–2000 (CTX-M-15, VIM, IMP, NDM-1, KPC, OXA-48, defectos de porina) (Tabla 1).38-41
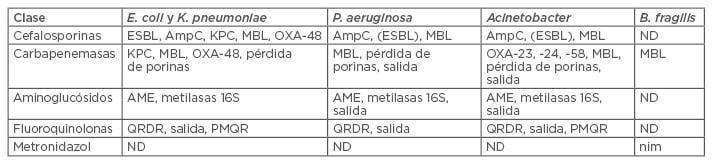
Tabla 1: Mecanismos resistentes Gram negativo.
AME: enzimas modificadoras de aminoglucósidos; B. fragilis: Bacteroides fragilis; E. coli: Escherichia coli; ESBL: β-lactamasa de espectro ampliado; K. pneumoniae: Klebsiella pneumoniae; KPC: K. pneumoniae carbapenemasa; MBL: metalo-β-lactamasa; NA: No disponible; P. aeruginosa: Pseudomonas aeruginosa; PMQR: resistencia a quinolona mediada por plásmido; QRDR: región determinante de resistencia a quinolona.
Las β-lactamasas de enterobacteriáceas, como por ejemplo E. coli, han estado evolucionando durante más de 50 años. Se reconocen cuatro clases de β-lactamasas: la clase A, que puede establecer resistencia a muchos β-lactámicos mediante la producción de ESBL y carbapenemasas como, por ejemplo, las carbapenemasas de la K. pneumoniae, que se han generalizado en muchas partes del mundo; la clase B, metalo-β-lactamasas, que son carbapenemasas; la clase C, cefalosporinasas; y la clase D, oxacilinasas.
La terminología utilizada para describir la resistencia ha estado evolucionando para mantener el ritmo de la crisis de resistencia. Los investigadores y médicos han reclasificado organismos de resistentes a RMF, hasta ampliamente resistentes a los fármacos y, finalmente, a panresistentes a los fármacos, para aquellas bacterias con resistencia a todos los antimicrobianos autorizados.42
Las infecciones graves de E. coli antes de la era de los antibióticos serían susceptibles a las 13 clases de antibióticos disponibles en la actualidad. La aparición de bacterias entéricas productoras de ESBL, después de la selección por esos mismos antibióticos, deja solo cuatro opciones de tratamiento parenteral en áreas de alta resistencia (tigeciclina, carbapenems, amikacina y colistina), la mayoría de los cuales representan un solo antibiótico en lugar de una clase; sin embargo, todas estas opciones tienen limitaciones. La resistencia mediada por plásmidos a polimixinas como la colistina es la última amenaza, y la toxicidad de los aminoglucósidos ha reducido todavía más la cantidad de antibióticos disponibles para combatir organismos resistentes. Esto ha resultado en un mayor uso de carbapenemasas, con la consecuencia inevitable de un aumento progresivo de la resistencia a estos agentes.
A día de hoy, las carbapenemasas están emergiendo en diversas formas, dentro de las bacteriass Gram-negativas. Las carbapenemasas de K. pneumoniae pueden encontrarse no solo en K. pneumoniae, sino también en otras bacterias entéricas. Tanto P. aeruginosa como los entéricos, producen metalo-β-lactamasas. También están surgiendo oxacilinasas capaces de inactivar carbapenemasas, tanto en Acinetobacter, como en K. pneumoniae y E. coli.
COMBATIR LA RESISTENCIA ANTIMICROBIANA
Desde las predicciones de Harold Neu, hace unos 25 años, se ha avanzado poco en la lucha contra la resistencia. Se necesita una mejor vigilancia, y mejorar el desarrollo de pruebas de diagnóstico para comenzar a abordar el aumento de la resistencia a los antimicrobianos. Las pruebas de diagnóstico molecular a partir de un único análisis de sangre para identificar infecciones bacterianas y virales, ayudarán a racionalizar el uso de antibióticos. La presión de un público cada vez más consciente y, en consecuencia, el aumento de la presión política, está llevando a realizar mayores esfuerzos contra la propagación de las bacterias RMF, así como a intentos de disminuir la aparición de resistencias, a través de una mejor administración de antibióticos. La clave de ambos enfoques es la prevención de la infección. Gracias a una mayor comprensión de la RAM fuera de la comunidad médica, se está acelerando la investigación de nuevos fármacos a través de una mayor colaboración entre las compañías farmacéuticas, los gobiernos y las organizaciones sin ánimo de lucro. Del mismo modo, una mejor coordinación mundial respaldada por distintas organizaciones, como la OMS, ayudará a combatir los patógenos resistentes de gran movilidad.43
TRATAMIENTO ADECUADO DE LA NEUMONÍA ADQUIRIDA EN LA COMUNIDAD: LECCIONES DEL ESTUDIO DE UN CASO
Una mujer de 78 años ingresó en el hospital. No había tenido de síntomas la noche anterior a la aparición rápida de escalofríos, fiebre (temperatura oral: 39,5 °C), dolor torácico pleurítico del lado derecho, tos no productiva leve, y disnea asociada con esfuerzo físico mínimo. La paciente tenía antecedentes de artritis reumatoide, tratada con prednisona (5 mg/día) durante los 3 meses anteriores; hipertensión leve controlada con hidroclorotiazida; y hospitalización por pielonefritis aguda 2 meses antes, durante la cual recibió tratamiento con fluoroquinolona. Vivía sola en el momento de la hospitalización.
El examen físico reveló que la paciente estaba lúcida y receptiva. Mostró taquipnea (frecuencia respiratoria: 35/min), taquicardia (frecuencia del pulso: 120/min), y su presión arterial era de 130/85 mmHg. La paciente parecía hidratada sin adenopatía periférica. El examen pulmonar reveló signos de consolidación, y estertores crepitantes en el hemitórax derecho. El ritmo cardíaco era regular sin murmullos. No había signos de congestión yugular o edema periférico. El abdomen era blando y sin organomegalias; el examen neurológico fue normal.
La posterior radiografía de tórax mostró un infiltrado bien definido, típico de neumonía. La extensión de la infección, también evaluada mediante una tomografía computarizada, fue lo suficientemente grande como para tocar la pleura, lo que explica el dolor pleurítico en el pecho.
Lecciones diagnósticas
La radiografía de tórax es la herramienta de diagnóstico esencial para la neumonía aguda. Además de confirmar el diagnóstico, puede indicar la presencia de complicaciones (derrame, absceso, tumor, etc.), proporcionar una posible evidencia de etiología, y permitir el seguimiento del progreso de la enfermedad.
Junto con la radiografía de tórax, los hemocultivos son la segunda herramienta de diagnóstico esencial, aunque no en la fase inmediata, debido a la demora en la recepción de los resultados. Los hemocultivos que confirman la infección bacteriana son casi exclusivamente positivos para neumococo, en pacientes sin factores de riesgo para infección por bacilos Gram-negativos. En aquellos con factores de riesgo, E. coli es el segundo microorganismo más común encontrado. Sin embargo, también se deben tener en cuenta otros patógenos. El inicio repentino y los primeros signos de consolidación en la paciente sugieren que, la Legionella pneumophila, es un candidato poco probable. Una infección oportunista como, por ejemplo, por Pneumocystis jiroveci, es poco probable debido a la fisura radiológica agudamente definida (la presentación del “cristal opalino” es más típica), la unilateralidad y las dosis bajas de prednisona que, probablemente, no causen inmunosupresión importante.
S. pneumoniae es el microorganismo candidato más probable. La edad del paciente, la hospitalización reciente y el pretratamiento con una fluoroquinolona (ciprofloxacina), deben alertar a los médicos sobre la posibilidad de una infección por neumococo RMF. En cuanto a los bacilos Gram-negativos, la probabilidad de infección por E. coli aumenta con la presencia de factores de riesgo como son el sexo femenino, la edad y la hospitalización reciente.
Lecciones terapéuticas
La edad de la paciente, per se, no es un factor de riesgo para un curso complicado de la enfermedad. Sin embargo, la combinación de edad y comorbilidades con posible inmunosupresión, representan factores de riesgo para un curso complicado y para las etiologías inusuales de neumonía adquirida en la comunidad. Además, la taquipnea es un signo físico grave de importancia pronóstica.
La neumonía aguda necesita terapia empírica con antibióticos. La azitromicina es una opción deficiente de antibiótico en este caso ya que, las infecciones neumocócicas, son con frecuencia resistentes a los macrólidos, y la azitromicina no es activa contra las infecciones Gram-negativas que, en este caso, siguen siendo una posibilidad. La amoxicilina tiene poco efecto contra la mayoría de las bacterias Gram-negativas de interés en la neumonía adquirida en la comunidad. Se debe considerar seriamente la ceftriaxona, ya que la resistencia de los neumococos a las cefalosporinas es muy baja, y la ceftriaxona también es activa en la mayoría de las bacterias Gram-negativas de interés en la neumonía adquirida en la comunidad. Sin embargo, no cubre la Legionella, u otros organismos “atípicos”. Una fluoroquinolona sería una buena opción si el tratamiento anterior con ciprofloxacina y el riesgo resultante de resistencia emergente del tratamiento en neumococos no contraindicaron su uso empírico. La terapia combinada ceftriaxona-azitromicina es la mejor opción para el tratamiento empírico de la neumonía grave adquirida en la comunidad, ya que cubre la gran mayoría de los posibles patógenos. Se ha demostrado que esta combinación es más eficaz que la monoterapia con un β-lactámico en algunos pacientes con neumonía neumocócica.
Respuesta al tratamiento
La paciente recibió una combinación IV de ceftriaxona-azitromicina y, al cabo de 48 horas, mostró mejoría, con una temperatura de 37,8°C y reducción de la sensación de dolor. Los resultados del hemocultivo revelaron la presencia de S. pneumoniae con resistencia intermedia a la penicilina (CIM: 1 mg/l). Los resultados permitieron a los médicos tratantes simplificar el tratamiento, cambiar a la vía oral y elegir un antibiótico clásico para reducir los costes.
El cambio a dosis orales es conveniente cuando el paciente muestra una mejoría sustancial, ya que reduce el riesgo de infección por catéter y trombosis venosa, además de facilitar el paso a tratamiento ambulatorio. En este caso, la monoterapia con amoxicilina fue viable porque, el grado de resistencia a la penicilina, se supera fácilmente con la dosis adecuada (1 gramo/cada 8 horas).