Meeting Summary
Este seminario especializado financiado mediante una contribución independiente realizada por OM/Vifor Pharma reunió a facultativos especializados en cirugía vascular, ginecología y dermatología de Pakistán, Egipto, Turquía, Líbano y Alemania para debatir acerca del manejo actual de la enfermedad venosa crónica (EVC) y la enfermedad hemorroidal. El seminario estuvo compuesto de presentaciones plenarias y debates interactivos sobre estudios de casos, permitiéndose a delegados y oradores participar en discusiones de mayor nivel sobre cuestiones candentes en este campo.
ENFERMEDAD VENOSA CRÓNICA: EPIDEMIOLOGÍA, FACTORES DE RIESGO, PATOFISIOLOGÍA Y DIAGNÓSTICO
Epidemiología
La EVC es una enfermedad preocupante que genera una carga significativa sobre los servicios sanitarios y la sociedad en general. A menudo, el primer signo de EVC es la aparición de venas varicosas. No obstante, la evolución a insuficiencia venosa crónica (IVC) se demora a menudo varios años, y se define por la presencia de edema y una Clasificación clínica, etiológica, anatómica y patofisiológica (CEAP) ≥C3, que supone un problema de mayor peso para el personal asistencial y los pacientes (Tabla 1). Asimismo, el síndrome postrombótico contribuye también a la carga de la enfermedad venosa con un perfil sintomático parecido pero más grave, que comienza con sensación de pesadez y evoluciona hacia dolor, edema y cambios en la piel.
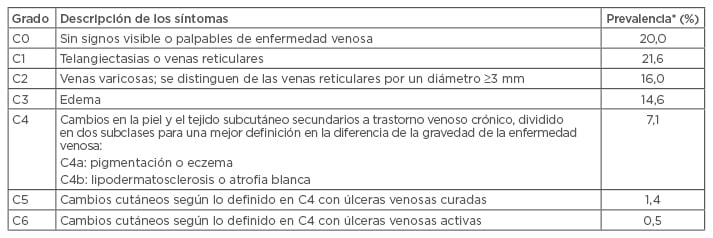
Tabla 1: Clasificación clínica, etiológica, anatómica y patofisiológica y prevalencia global de la enfermedad venosa crónica.
Adaptación de Eklöf et al., 2004.3 *Datos de Rabe et al. 2012.1
Datos del programa internacional de cribado y concientización Vein Consult Program muestran que predominan las primeras etapas de la EVC.1 Las venas varicosas y el edema afectan a alrededor del 15 % de la población mundial (Tabla 1). La enfermedad grave, caracterizada por úlceras venosas activas o curadas, afecta aproximadamente al 2 % de la población mundial (Tabla 1), con una carga concomitante significativa sobre los sistemas sanitarios y los pacientes.2 Estudios más recientes con referencia en la clasificación CEAP y desarrollados en Europa y los EE. UU., sitúan la enfermedad grave en intervalo C4−C6 en aproximadamente el 5 %, mientras que la prevalencia de C2−C3 estaría en torno al 25 %, con lo que la EVC moderada a grave sería una patología muy frecuente. Estas cifras parecen permanecer relativamente constantes por países, incluyendo el conjunto de Medio Oriente y el sur de Asia.
La prevalencia de la IVC aumenta drásticamente con la edad, y las úlceras venosas afectan al 20,7 % de las personas >80 años de edad, en comparación con el 0,3 % de los situados en el intervalo 41−50 años.4 Se considera que la EVC es una enfermedad más común entre las mujeres, aunque la afectación de ambos sexos es considerable. Mientras que la incidencia de venas varicosas en superior en las mujeres que en los hombres (13,9–46,3 % de las mujeres y 11,4–29,3 % de los hombres sobre un total de 50.974 personas de Europa y los EE. UU.),5-10 la prevalencia es similar en los hombres y mujeres que nunca han estado embarazadas. La influencia del sexo en las formas menos graves de la enfermedad venosa no está clara. Además, en el Estudio Venoso de Edimburgo, las venas varicosas eran más comunes en los varones en el contexto de la población general. Datos del Estudio Venoso de Bonn indican que las mujeres con EVC suelen informar con más frecuencia la ocurrencia de síntomas en las 4 semanas anteriores a la consulta que los hombres. Estas diferencias pueden duplicarse al hablar de síntomas tales como pesadez (23,8 % frente a 11,1 % en mujeres y hombres, respectivamente) y dolor asociado con estar de pie (24,2 % frente a 14,4 % en mujeres y hombres, respectivamente). Esta podría ser una de las razones por las que los hombres con venas varicosas rara vez solicitan su tratamiento, y acuden a consulta en etapas tardías de la IVC.
La EVC supone una carga socioeconómica de gran peso en todo el mundo. En Europa Occidental, el 2 % (900 millones de €) del presupuesto sanitario anual se dedica a enfermedades venosas crónicas, siendo su equivalente unos 2.500 millones de $ en EE.UU. Ello supone un impacto en el presupuesto mayor que el de la enfermedad arterial. Las úlceras venosas contribuyen en la pérdida de 2 millones de días de trabajo anualmente en EE. UU.; la EVC en términos generales implica una pérdida de 4 millones de jornadas perdidas anualmente en Francia. El coste anual de la pérdida de días laborables varía entre los 270 millones de € en Alemania y los 320 millones de € en Francia, siendo de 3.000 millones de en EE. UU.11,12
Factores de riesgo
Los factores de riesgo por venas varicosas no son modificables, e incluyen edad, genética y ser mujer o el embarazo. No obstante, la IVC sí incluye factores de riesgo modificables y no modificables, que incluyen edad, obesidad, hipertensión y exceso de tiempo sentado o de pie. La edad avanzada es el factor de riesgo más importante tanto para las venas varicosas como para la IVC. En el gran estudio poblacional transversal de San Diego, la oportunidad relativa (odds ratio, OR) en edad avanzada era de 2,42 para las venas varicosas y de 4,85 para la IVC.5,10 En el Estudio venoso prospectivo ampliado de Bonn, la OR para venas varicosas en el intervalo de los 70–79 años fue de 15,9.9,10,13 La obesidad es el factor de riesgo modificable para IVC más significativo, y afecta a entre tres cuartos y dos tercios de los pacientes. La etapa tardía de la IVC, caracterizada por las úlceras, es muy rara en pacientes no obesos. La presencia de factores de riesgo modificables en IVC ofrece la posibilidad de establecer estrategias de profilaxis.
Fisiopatología
La principal característica de la fisiopatología de la EVC es el reflujo, producido principalmente por incompetencia y obstrucción valvular. La obstrucción y el reflujo pueden darse de forma individual o combinados, y empeoran por la disfunción o la inactividad de la bomba muscular. Estos factores dan como resultado el aumento de la presión venosa ambulatoria, que da lugar a hipertensión venosa ambulatoria. El aumento de la presión venosa y la reducción del flujo sanguíneo provocados por los mecanismos anteriores son los principales promotores de los elementos patológicos resultantes de la EVC.
Hasta el cambio de siglo, base teórica para la fisiopatología de las venas varicosas se fundamentaba en el fenotipo descendente de la evolución de la enfermedad. La «teoría descendente» sostiene que la enfermedad se inicia en la parte superior, a la altura de las confluencias safeno femoral o safeno poplítea, seguida por extensión de los troncos y de las tributarias superficiales.11 Sin embargo, durante los últimos 10–15 años, ha ganado aceptación la «teoría ascendente», que sugiere un origen multifocal con inicio en las tributarias y desplazamiento a los troncos, y posteriormente a las confluencias.10,14
La inflamación desempeña un papel fundamental en el fallo valvular y en la remodelación de la pared venosa, y ambos contribuyen al reflujo y la hipertensión. El aumento de la presión hidrostática y la reducción del flujo sanguíneo activan la expresión de genes inflamatorios en el endotelio vascular. Esto conduce al movimiento, la adhesión y la migración de leucocitos. Los efectos anteriores contribuyen a la inflamación y a la formación de radicales libres que, a su vez, inducen apoptosis y necrosis tisular. Por lo tanto, el daño valvular y en la pared venosa que se producen en la enfermedad venosa primaria se reafirma en sí mismo.15-17
De forma similar, en el plano microvascular, la reducción del flujo sanguíneo y el incremento de la tensión da lugar a la activación de la interacción célula-célula, lo que induce el atrapamiento de los leucocitos y, a su vez, resulta en la liberación de mediadores de inflamación. La inflamación lleva a la apertura de la barrera endotelial y la filtración de células endoteliales capilares. Cuando el fluido que sale del capilar (filtración capilar) supera el flujo linfático, se produce el edema intersticial. El fluido y las células inmunológicas activas que entran en el tejido adyacente ocasionan una nueva liberación de medidores inflamatorios que empeoran el edema y causan dolor e incomodidad. Dado que los mecanismos patológicos que causan directamente el edema se producen en la microcirculación, esta es el objetivo principal de las intervenciones farmacológicas contra la IVC.
Diagnóstico
La existencia de sensación de pesadez, cansancio e hinchazón es un elemento diagnóstico de la EVC, y puede ayudar a diferenciar la EVC de otros focos de dolor en la pierna como la enfermedad arterial oclusiva. Además, un dolor que aumenta a lo largo del día, con temperaturas cálidas y, sobre todo, al permanecer en bipedestación y no caminando, indica una patología venosa. Las técnicas diagnósticas pueden dividirse en tres niveles: 1) antecedentes y examen; 2) técnicas de imagen no invasivas; y 3) técnicas de imagen complejas o invasivas. La Sociedad Europea de Cirugía Vascular (ESVS) recomienda la recopilación de antecedentes y el examen físico con un nivel de datos documentales de 1C.10
El sistema CEAP (Tabla 1) está aceptado de forma general como el mejor de los sistemas de documentación diagnóstica disponibles (1B). También existe una serie de sistemas suplementarios de puntuación clínica. Parece ser que, a pesar del impacto positivo en la valoración de la gravedad de la enfermedad y del bienestar del paciente, la escala Venous Clinical Severity Score está siendo subutilizada en algunos entornos clínicos (2aB).10 Las escalas Venous Segmental Disease Score (VSDS) y Venous Disability Score (VDS) también son herramientas diagnósticas útiles (2aB).10 El uso habitual de estas pruebas adicionales es cada vez más frecuente, y debe ser fomentado.
Debería incorporarse al examen clínico la valoración de la calidad de vida (CdV). La CdV está estrechamente relacionada con la gravedad de la enfermedad y con las mejoras inducidas por el tratamiento, y tiene cada vez mayor consideración como criterio de valoración principal al evaluar tratamientos novedosos.10 Están disponibles una serie de medidores de la CdV, tanto generales como específicos para la enfermedad venosa, y están recomendados por la ESVS (2aB). Tanto los componentes físicos como psíquicos del cuestionario general SF-30 pueden detectar el impacto de la EVC en la CdV. Los datos indican que el Estadio C3 tiene un impacto similar a la diabetes o el cáncer, mientras que el Estadio C5–C6 tiene un impacto similar a la insuficiencia cardíaca.18 El cuestionario sobre calidad de vida Aberdeen Varicose Vein Quality of Life (AVVQ), junto con el cuestionario Chronic Venous Insufficiency Questionnaire (CIVIQ), y el cuestionario del Venous Insufficiency Epidemiological and Economic Study, suponen formas de medición de buen nivel y con especificidad para la enfermedad a la hora de evaluar la respuesta al tratamiento (2aB).10
En cuanto a las técnicas de imagen no invasivas, la ecografía dúplex (DUS) es actualmente el criterio de referencia en todo el mundo (1A).11 En la mayoría de los casos, la ecografía dúplex es suficiente para investigar el sistema venoso profundo, y se debería utilizar antes de contemplar la flebografía, la venografía por tomografía computarizada (CTV) o la venografía por resonancia magnética (MRV) en el caso de venas pélvicas o abdominales difíciles de visualizar (1C).11 Gracias a la adopción de la ecografía dúplex, el Doppler portátil se considera obsoleto en la actualidad.10
En aquellos casos en que las venas abdominales o pélvicas no se pueden visualizar mediante la ecografía dúplex, se utilizan con frecuencia CTV y MRV en los centros bien equipados, pudiendo actualmente conseguir imágenes tridimensionales (1C).10 Con estas técnicas es ahora posible obtener un diagnóstico fiable de patologías abdominales como el síndrome del cascanueces, el síndrome de May–Thurner y el varicocele pélvico.10 Las técnicas invasivas como la flebografía están recomendadas cuando las otras herramientas no permiten conseguir resultados concluyentes (2bB).10
MANEJO DE LA ENFERMEDAD VENOSA CRÓNICA
El tratamiento de la IVC pretende mejorar la función venosa y los signos y los síntomas de la IVC. El abordaje de los signos como síntomas es el objetivo más importante del tratamiento desde el punto de vista del paciente; sin embargo, no siempre es concomitante con la mejora de la función venosa. Por ejemplo, la frecuente recurrencia de úlceras venosas posteriores a un tratamiento invasivo se origina en una patología microcirculatoria continua, que no se ve afectada por el tratamiento del reflujo venoso.
El manejo también debe abordar la naturaleza progresiva de la IVC y actuar como profiláctico frente al agravamiento y al avance.19 El tratamiento comprende opciones terapéuticas tanto conservadoras como invasivas. Entre los tratamientos conservadores se incluyen el tratamiento físico, como la participación en deportes o el aumento del movimiento, y el tratamiento compresivo y la terapia farmacológica. Entre las modalidades de tratamiento invasivo están la cirugía de las venas superficiales y profundas, entre ellas la flebectomía percutánea mediante ganchos y técnicas de stripping. Las nuevas opciones de tratamiento menos invasivas incluyen la escleroterapia mediante espuma, la ablación térmica endovenosa y las técnicas de ablación por radiofrecuencia.20-22 Estas técnicas ofrecen buenos resultados a mediano plazo, y su eficacia es comparable al stripping, aunque se debe tener en cuenta el diámetro venoso al tomar decisiones terapéuticas, pues las venas varicosas más grandes pueden no ser susceptibles a tratamiento con estas técnicas menos invasivas.
Terapia compresiva
La terapia compresiva constituye la base del manejo terapéutico de la IVC. Además de los efectos físicos manifiestos sobre el edema, la compresión reduce la inflamación al contraer los espacios entre las células del endotelio vascular y reducir las interacciones célula-célula. También disminuye la hipertensión venosa intermitente y mejora la velocidad del flujo capilar y venular, de modo que aborda los causantes primarios de la patología IVC. La compresión mejora la hemodinamia mediante la promoción de la bomba venosa y la reducción del reflujo venoso. Mientras tanto, la formación de edemas se corrige con la mejora de la microcirculación y la promoción del drenaje linfático. La reducción del edema da lugar a una mejora de los síntomas, con la ventaja añadida de que los efectos son inmediatos.
El tratamiento compresivo asume varias formas, como las vendas, las medias y la compresión neumática intermitente, que está emergiendo como un método nuevo con potencial para la tromboprofilaxis. Para la EVC, las indicaciones de las medias de compresión varían según su presión. Las medias de baja presión (10–20 mmHg) están indicadas para el tratamiento de la clasificación CEAP C0–C1 con el objetivo de evitar la hinchazón, la pesadez de piernas, la sensibilidad y el dolor. La prevención de los síntomas en el estadio C2, y la reducción del edema en el estadio C3 precisa de medias de presión más alta, entre 20–30 mmHg. Las medias de presión de 30–40 mmHg están indicadas tanto para la prevención de las úlceras (C4) como la prevención de su recurrencia (C5). Por su parte, la curación de la úlcera y el alivio del dolor en pacientes con IVC C6 requiere el uso de medias de compresión con presiones de ~40 mmHg.
El documento de consenso de 2008, que será actualizado próximamente, ha identificado una serie de insuficiencias en las pruebas científicas para la terapia de compresión.23 En la actualidad, existen pocas recomendaciones a las que se haya atribuído el nivel de evidencia más alto, el 1A. La prevención de tromboembolismos venosos mediante compresión a baja presión y la prevención de úlceras C6 con vendajes compresivos son recomendaciones de nivel 1A; sin embargo, el uso de medias de alta compresión para la prevención del síndrome postrombótico, que tiene actualmente clasificación 1A, es probable que se vea rebajado a la vista de la solidez de los datos del estudio SOX.24 El aumento en la cantidad de datos disponibles que apuntan a que la compresión postquirúrgica para el alivio del dolor solo es eficaz durante la primera semana tras la cirugía es probable que influya también en las recomendaciones que figuren en el nuevo documento de consenso.
Fármacos venoactivos
La acción de los fármacos venoactivos es muy similar a la de la terapia compresiva. Los fármacos venoactivos reducen la inflamación de la pared venosa, disminuyen la formación de edema y el desarrollo de cambios cutáneos, y protegen a las células endoteliales de la contracción. Los fármacos venoactivos son un grupo heterogéneo, muchos de los cuales proceden de extractos de plantas (Tabla 2). También es heterogénea la base científica que los sustenta, existiendo un número significativo de tratamientos para los que no se dispone de estudios con revisión científica externa o esta es insuficiente.
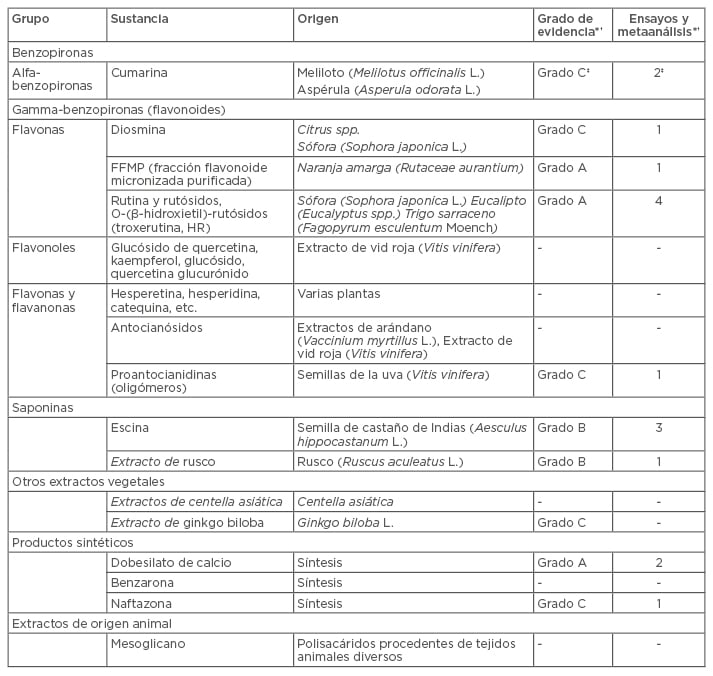
Tabla 2: Resumen de fármacos venoactivos.25,26
†Al valorar el grado de solidez científica solo se consideraron aquellos ensayos que evaluaban síntomas. ‡Datos extraídos del tratamiento combinado cumarina-troxerutina.
FFMP: fracción flavonoide micronizada purificada.
Adaptación de Ramelet et al., 2005.25 *Basado en datos procedentes de Nicholaides et al., 2008.26
El alivio de los síntomas es el principal objetivo del tratamiento farmacológico, y existen pruebas sólidas de que se produce un efecto objetivo sobre el edema y los síntomas venosos (el nivel de evidencia se sitúa en la mayoría de los casos entre 1 y 2B, dependiendo de la sustancia utilizada). Que el tratamiento farmacológico pueda curar la EVC sigue sin estar claro, pero hay pruebas que sugieren podría influir en la curación de úlceras en las piernas. Asimismo, el uso profiláctico de los fármacos venoactivos debe aún ser investigado en profundidad, a pesar de que la fisiopatología de la EVC y los mecanismos antiinflamatorios de los fármacos venoactivos apuntarían a un posible retraso de su progresión. Los datos disponibles indicarían que el uso de fármacos venoactivos es tanto seguro como económico, siendo los efectos secundarios a nivel digestivo el principal efecto negativo.25,26
A pesar de que existen pruebas sólidas de que se consigue un efecto objetivo, algunos médicos cuestionan la trascendencia clínica que consiguen los fármacos venoactivos en la reducción del edema. Datos de un análisis de 2006 muestran que la mayoría de las reducciones se sitúan en el intervalo de los 40–50 ml, lo que no parece tener relevancia clínica teniendo en cuenta el volumen de la pantorrilla en su conjunto.27 No obstante, esta comparación se basa en una serie de supuestos erróneos. En primer lugar, la volumetría de desplazamiento del agua, principal método utilizado en la evaluación del edema, mide sobre todo la zona del pie y del tobillo, lo que representa en torno a 2.500–3.000 ml. A pesar de que este sigue siendo un gran volumen en comparación con las reducciones obtenidas con fármacos venoactivos, el edema venoso se produce sobre todo en el cutis y subcutis, lo que representa aproximadamente un 20 % de este volumen (600 ml). Asimismo, alrededor de un tercio de este tejido graso está compuesto de agua, con lo que el volumen de tejido expuesto al edema se reduce a unos 200 ml. Hechos estos ajustes, el efecto conseguido por los fármacos venoactivos representa de hecho una reducción de volumen de en torno al 25 %.
Otra polémica tiene que ver con el lugar que ocupan los fármacos venoactivos a nivel terapéutico, y si pueden reemplazar a la terapia compresiva, a la cirugía o a ambas. La mayoría de los fármacos venoactivos necesitan de un periodo de preinclusión de entre 3−4 semanas antes de ser eficaces en la reducción del edema, por lo que no podrían sustituir a la terapia compresiva en muchos casos en que es necesaria una reducción inmediata del edema. Asimismo, a diferencia de las intervenciones quirúrgicas, los fármacos venoactivos no pueden restaurar las venas varicosas ni resolver la obstrucción. De hecho, las intervenciones farmacológicas representan un excelente tratamiento sinérgico junto con la terapia compresiva y las intervenciones quirúrgicas, más que una posible solución sustitutiva.
DOBESILATO DE CALCIO: EFICACIA CLÍNICA EN EL TRATAMIENTO DE LA ENFERMEDAD VENOSA CRÓNICA SINTOMÁTICA
El dobesilato de calcio afecta una serie de mecanismos patofisiológicos, mejorando los síntomas de la IVC. Estos mecanismos podrían clasificarse en términos generales como efectos en los capilares y la pared venosa, efectos en los componentes de la sangre y efectos en la circulación linfática.28,29
Entre los efectos del dobesilato de calcio en los capilares y la pared venosa están: reducción de las especies de oxígeno reactivo, reducción de los factores apoptóticos, mejora de la disfunción endotelial, inhibición de la adhesión leucocitaria al endotelio y reducción de la permeabilidad de la pared capilar a través de la actividad contra el factor de crecimiento endotelial vascular, así como inhibición de las alteraciones en las proteínas de las uniones celulares.28-35 Estos mecanismos combinados actúan mejorando el funcionamiento de los capilares y la pared venosa, reduciendo la extravasación de sangre y fluidos y, por consiguiente, la formación de edema.
El dobesilato de calcio actúa sobre los componentes de la sangre reduciendo la fragilidad de los eritrocitos e inhibiendo la agregación plaquetaria, reduciendo también la viscosidad plasmática.36,37 Estos efectos pueden a su vez limitar la trombosis en la microcirculación y el síntoma asociado con ella, la atrofia blanca.
Por último, la mejoría en la captura de fluidos y macromoléculas del espacio extracelular y la aceleración del flujo linfático influye en la normalización de la fisiología linfática y la mejora de los síntomas.38,39 En los últimos 10 años se ha llegado a entender mejor la importancia de este mecanismo, ya que la solidez de los datos acumulados apunta ahora a que ≥90 % de los fluidos que contribuyen al edema son reabsorbidos por el sistema linfático.40-42
Efectos clínicos del dobesilato de calcio
Los datos clínicos disponibles indican que el dobesilato de calcio es eficaz para reducir los síntomas y signos de la IVC. Un metaanálisis de 2001 de Espinosa y Giannone43 resumía los resultados de cuatro estudios clínicos aleatorizados, doble ciego y controlados mediante placebo en los que se administraron a los pacientes 1,5 g de dobesilato de calcio por día o placebo durante 4 semanas al menos (N=324). El dobesilato de calcio consiguió mejoras significativas sobre los síntomas subjetivos más frecuentes en comparación con el placebo.
Un ensayo doble ciego y controlado mediante placebo con dobesilato de calcio de 2004 (1,5 g al día durante 4 semanas) en pacientes ambulatorios (N=253) con IVC (CEAP: C3−4) investigó sus efectos en el edema y el volumen de la pierna. A pesar de que fuese necesario un periodo de preinclusión de entre 3 y 4 semanas para que se iniciase la reducción del edema, se produjo una reducción significativa (p=0,0109) del 48 % en el volumen de la pierna en IVC moderada a las 4 semanas de tratamiento con dobesilato de calcio (Figura 1a). Tras la retirada del tratamiento, se produjo una reversión parcial del edema, aunque ensayos posteriores sugieren que se podría conseguir un efecto a largo plazo con dobesilato de calcio. En pacientes con IVC más grave (pacientes previamente tratados, CEAP en estadío C4, o duración de la IVC >12 años) se consiguió una reducción del 77 % (Figura 1b).44 Un metaanálisis más reciente de Ciapponi et al.45 de tres ensayos con dobesilato de calcio (N=608) encontró resultados similares, incluyendo una mejora superior en términos de dolor, pesadez e hinchazón de los tobillos en pacientes en estadíos graves de la enfermedad, en comparación con aquellos que padecían IVC leve.

Figura 1: Cambios en el volumen de la pierna durante el tratamiento con dobesilato de calcio o placebo en pacientes con.
A) insuficiencia venosa crónica moderada o B) insuficiencia venosa crónica más severa.44
Copyright © 2016 European Medical Journal. Reimpresión bajo licencia de SAGE Publications, Ltd.
Con el fin de ajustarse a las recomendaciones actualizadas, se investigó el efecto del dobesilato de calcio en el dolor y el volumen de la pantorrilla a lo largo de 8 semanas en un ensayo multicéntrico, doble ciego y controlado mediante placebo (N=256). Los pacientes padecían IVC sintomática y edema con fóvea (C3–C5), así como al menos un síntoma como molestias o dolor. Se midió el volumen de la pantorrilla con el método de la circunferencia en lugar de hacerlo por volumetría de desplazamiento de agua. El volumen de la parte inferior de la pantorrilla disminuyó en el grupo tratado con dobesilato de calcio hacia el final del periodo de tratamiento activo en 64,7 ml, en comparación con los 0,8 ml del grupo de placebo (p=0,0002), independientemente del uso de medias compresivas. En ambos grupos se produjo una reducción del dolor, pero fue mucho más marcada en el grupo de dobesilato de calcio en comparación con el de placebo (p=0,0071).46
Debido a la preferencia que algunas autoridades sanitarias dan a la medición por volumetría de desplazamiento de agua, se realizó un estudio similar utilizando este tipo de medición para la evaluación del edema. Este estudio aleatorizado, doble ciego y controlado con placebo evaluó los efectos del dobesilato de calcio a dosis de 1,5 g/día a lo largo de 12 semanas en pacientes con IVC en estadío C3–C4 (N=351). No se alcanzó en este estudio el objetivo en términos de cambio del volumen relativo en la pierna más patológica desde el inicio hasta la Semana 12 (-0,6 % frente a -0,3 %; p=0,09), debido probablemente a una serie de violaciones al protocolo en cuanto a la volumetría de desplazamiento de agua atribuíbles al laboratorio. No obstante, en el periodo de seguimiento posterior de 24 semanas, los pacientes tratados previamente con dobesilato de calcio mostraron un cambio significativo tanto en términos de volumen relativo (-1,01 % frente a -0,08 %; p=0,002) como absoluto (-25,7 ml frente a -1,1 ml; p=0,002) en comparación con el placebo. Estos datos sustentarían un efecto putativo a largo plazo del dobesilato de calcio que respaldaría la continuidad del esfuerzo investigador, y que podría influir en futuras recomendaciones relativas al curso óptimo del tratamiento con dobesilato de calcio.47
Se ha destacado con anterioridad la importancia de los datos sobre calidad de vida en la IVC. En el estudio anterior, la puntuación secundaria CIVIQ sobre calidad de vida en cuanto a valoración del dolor o la incomodidad en tobillos o piernas en las últimas 4 semanas mejoró significativamente hacia la Semana 12 en el grupo de dobesilato de calcio (p=0,03) en comparación con los valores de referencia, aunque esta diferencia no resultó significativa al compararla con el placebo.47 Los datos sobre calidad de vida a largo plazo de un estudio de 2008 de Martínez-Zapata et al.,48 mostraron una diferencia significativa a favor del dobesilato de calcio en comparación con el placebo a los 12 meses (p=0,02). En este estudio, como en el estudio de 2016 de Rabe et al.,47 la calidad de vida mejoró tanto en el grupo de dobesilato de calcio como en el de placebo hasta el tercer mes. A largo plazo sin embargo, la calidad de vida seguía mejorando en el grupo de dobesilato de calcio, mientras que en el grupo placebo se deterioraba hasta un punto por debajo de los valores de referencia.48
Documentos de consenso y recomendaciones
El documento del Consenso de Siena representa una de las primeras recomendaciones para el tratamiento de la IVC. Las recomendaciones contenidas en este documento se basaban en datos relativos a la mejora de los síntomas, más que en signos clínicos como el edema.25 El documento de Siena clasificaba el uso de fármacos venoactivos para la IVC con el nivel de evidencia A, lo que fue confirmado en las Recomendaciones internacionales para el manejo de la EVC publicadas en 2008, que recomendaban el uso específico de dobesilato de calcio con un nivel de evidencia A basándose en dos ensayos/metaanálisis (Tabla 1).25,26 En relación con otros fármacos venoactivos, la fracción flavonoide micronizada purificada (MPFF) también se recomendaba con el Grado A, mientras que los restantes tratamientos farmacológicos se clasificaron bajo los grados C o B, no siendo aconsejados como tratamientos de primera línea.26 La actualización de 2014 de estas recomendaciones clasificaba la MPFF en el Grado 1B, frente al 2B atribuido al dobesilato de calcio, a pesar de que ambos fármacos están sustentados en el mismo nivel de datos clínicos (B).49 En una evaluación más técnica de los datos procedentes del Informe de evaluación de la tecnología sanitaria austriaco de 2014, solo el dobesilato de calcio aparecía con un nivel de respaldo moderado procedente de ensayos controlados mediante placebo, estando el resto de tratamientos pobremente sustentados en datos.
Los datos más rigurosos y actualizados de que se dispone en la actualidad sobre los fármacos venoactivos proceden del informe Cochrane de 2016 sobre flebotónicos para la IVC. Se evaluaron sesenta y seis ensayos aleatorizados y con grupo control, de los que 53 (N=6,013) proporcionaron datos cuantificables. La mayoría de los ensayos se centraban en los rutósidos (28), seguidos de la hidrosmina y la diosmina (10), y el dobesilato de calcio (9). La mayoría de los estudios eran defectuosos, y solo cuatro mostraban un riesgo de sesgo bajo. De estos estudios de gran calidad, tres evaluaban el dobesilato de calcio, y uno la terapia combinada con cumarina/troxerutina. Los autores concluían por apuntar que, de acuerdo con datos de calidad intermedia, los flebotónicos tienen efectos beneficiosos en el edema y en algunos signos y síntomas de la IVC en comparación con el placebo. El riesgo de efectos secundarios gastrointestinales aumentaba respecto al placebo. El metaanálisis no encontró diferencias en cuanto a curación de úlceras, aunque muy pocos estudios contemplaron este aspecto. En conclusión, los autores destacaron también la necesidad de contar con un mayor número de ensayos aleatorizados y con grupo control de calidad para mejorar la base sobre la que sustentar el uso de flebotónicos en IVC.50
IMPACTO DE LA ENFERMEDAD VENOSA CRÓNICA EN EL RESCATE DE MIEMBROS DIABÉTICOS
Las úlceras de pierna pueden agruparse entre las que son principalmente de origen venoso (Grupo I: 75 %), las que tienen origen mixto venoso y arterial (Grupo II: 14 %), y las influidas tanto por IVC como por diabetes (Grupo III: 9 %), que suelen afectar con más frecuencia al pie. Las úlceras del Grupo II reciben a menudo un diagnóstico erróneo, con lo que las estrategias terapéuticas acaban por ser incompletas o equivocadas. Las úlceras de origen mixto tanto diabético como venoso (Grupo III) suponen un desafío terapéutico significativo, a menudo no siendo posible curarlas y acabando en la amputación del miembro.
El cuarenta por ciento de las lesiones de pie diabético está asociado con IVC. La combinación de las características de la diabetes y la IVC dan lugar a úlceras resistentes al tratamiento, que aumentan el riesgo de pérdida del miembro. Al dar con un paciente con úlceras diabético e IVC, es preciso llevar a cabo un examen general seguido de examen regional y, por último, local. Es necesario tener en cuenta elementos etiológicos generales subyacentes que pudieran influir en la formación de úlceras, como pueden ser artritis reumatoide, lupus sistémico y diabetes no controlada. Acto seguido, debe prestarse atención a elementos etiológicos como la isquemia y la IVC, ya que pueden retrasar el proceso de curación. Por último, se deben considerar factores patológicos locales como isquemia arterial, hipertensión venosa y edema linfático.
La experiencia recabada en grandes centros que reciben un número elevado de remisiones para amputación de miembros por lesiones de pie diabético apunta a que la pérdida de miembros en pacientes diabéticos se debe a la carencia de equipos especializados en cuidado del pie, combinada con estrategias de tratamiento demasiado ceñidas a la especialidad del clínico, en lugar del empleo de estrategias terapéuticas referenciadas a la patología. Por ejemplo, un cirujano vascular que no encuentre pulso en un pie afectado por lesiones diabéticas podría pensar en un caso vascular. La investigación y corrección del origen del problema, como puede ser una oclusión femoral superficial, puede no conducir a la curación de la lesión diabética, ya que factores como una mala calidad de la sangre habrán sido obviados por un especialista demasiado centrado en la enfermedad vascular. Estos problemas podrían superarse con la supervisión por un equipo multidisciplinario; no obstante, en el entorno clínico habitual, la disponibilidad de este tipo de equipos es muy reducida, incluso en sistemas sanitarios muy avanzados como el estadounidenses.
Un artículo de reciente publicación intentó desarrollar una estrategia para superar estas cuestiones empleando datos de los análisis internos realizados por un grupo de hospitales clínicos de El Cairo. Los análisis identificaron seis factores etiológicos modificables en pacientes con lesiones de pie diabético remitidos para amputación mayor. Se analizó después de forma prospectiva el impacto del tratamiento dirigido hacia estos factores modificables (calidad de la sangre [haemoglobin <9 g/dl and/or serum albumin <3 g/dl], cantidad de sangre, lesiones óseas, enfermedades asociadas, pérdida tisular y cirugía local de pie previa) a lo largo de 5 años y sobre una población de 4.102 pacientes.51
En este estudio, estaba presente uno de los seis factores etiológicos identificados en todos los casos remitidos y, en la mayoría de los casos, estaban presentes dos factores hormonales (78 %). El factor etiológico más común era la calidad de la sangre (66 %), siendo el menos común la pérdida tisular (8%). La presencia de alguna enfermedad asociada, lo que incluía a la IVC, era un factor presente en el 28 % de los casos.51
El uso de un paradigma terapéutico con orientación etiológica resultó en el rescate de los miembros de la mayoría de los pacientes remitidos para amputación. Aquellos casos en que existían enfermedades asociadas, como la IVC, fueron aquellos en los que el tratamiento dio mejor resultado, llegando a amputación mayor solo el 16 %; mientras que los asociados con pérdida tisular y cirugía de pie previa fueron los menos satisfactorios, necesitando amputación el 35 % y el 52 % respectivamente (Figura 2). Se consideró que los casos con cirugía de pie previa eran los más problemáticos, debido a una historia de pérdida tisular progresiva causada por intervenciones localizadas acometidas sin que se hubiese intentado atender la etiología subyacente en forma adecuada.51
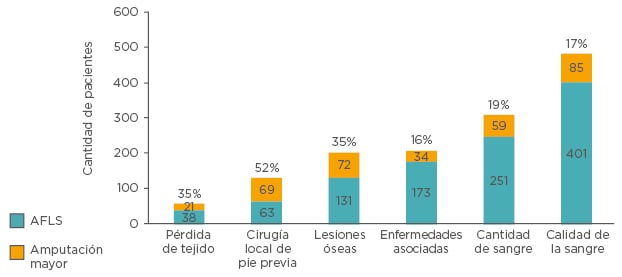
Figura 2: Amputación mayor y rescate de miembro sin amputación tras tratamiento etiológico basado en referencias clave en pacientes con úlcera diabética remitidos para amputación mayor.
Los autores aconsejaron la aplicación del protocolo para pie diabético para identificar, detectar y corregir todos los elementos etiológicos como parte de un plan estratégico de manejo. También se aconsejó el uso de una clave de color que apareciese en la primera página de la ficha del paciente. Por último, se insistió en desaconsejar una clasificación de pacientes por especialidad respectiva del médico por los efectos que podría tener en el posterior descubrimiento de elementos etiológicos.
AFLS: rescate de miembro sin amputación.
RESUMEN DE ESTUDIOS DE CASO
Estudio de caso 1
Mujer de 79 años con úlcera venosa en una pierna. La paciente tenía una pequeña safena varicosa en la pierna derecha, y se quejaba de pesadez, dolor e hinchazón. Se consiguió curar la úlcera después de aplicar tratamiento con láser y compresión. No obstante, no se eliminó el dolor moderado, la sensación de pesadez y un edema leve. Al cabo de 6 semanas de tratamiento con 1,5 g/día de dobesilato de calcio, desapareció la sensación de pesadez y el edema.
Estudio de caso 2
Varón de 49 años con peso y altura medios que acudió a consulta por historial de trombosis venosa profunda poplítea recurrente (TVP), que supuso 3 ataques en los 4 años anteriores. Los resultados de laboratorio fueron normales, y el paciente resultó negativo para proteínas C y S, así como para la mutación del factor V Leiden. El paciente tomaba anticoagulantes orales habitualmente, y su índice internacional normalizado era 2,2–3,0. La presentación aguda del paciente implicaba un edema progresivo rápido del miembro izquierdo y cianosis del pie, sin edema en ingle ni escroto. La presentación clínica era de flegmasía dolorosa, y la ecografía dúplex mostró TVP iliofemoral izquierda.
Se prescribió tratamiento trombolítico por la flegmasía dolorosa y la cianosis del pie. Se insertó un filtro en la vena cava inferior a través de la vena femoral derecha. Después se insertó un catéter de perfusión por la ruta poplítea, ascendiendo por la vena poplítea hasta la iliofemoral izquierda, dejando actuar el tratamiento con activador tisular del plasminógeno 24 horas, lo que supuso una rápida resolución del edema. No obstante, después del tratamiento, la venografía reveló que la etiología subyacente era un síndrome de compresión de la vena ilíaca común izquierda por la arteria ilíaca común derecha. Tras la dilatación, se introdujo una endoprótesis y se dejó recuperarse al paciente en observación durante dos días, lo que supuso una resolución del problema sin recurrencias durante >17 años.
Estudio de caso 3
Varón de 65 años sin historia de diabetes ni hipertensión con pierna izquierda hinchada, estando presente el problema en los últimos 10 meses, y con una pequeña hinchazón en la ingle izquierda. La ecografía dúplex permitió descubrir una trombosis aguda en la vena poplítea femoral, un trombo flotante no adherido en la vena femoral común y una vena ilíaca izquierda comprimida y estrechada producida por una masa de tejido blando. La resonancia magnética (RM) mostró una agrupación de ganglios linfáticos ilíacos externos que envolvía a los vasos ilìacos externos e internos. La función de las arterias se había visto amplificada, mientras que la de las venas estaba reducida, estando la vena ilíaca externa izquierda comprimida por la masa linfadenopática y por la agrupación de ganglios ilíacos externos izquierdos.
La biopsia reveló que era un linfoma no-Hodgkin; el linfoma era de naturaleza folicular y estaba caracterizado por folículos macroscópicos que se encontraban en secciones transversales del ganglio linfático. Se sabe que el tratamiento de este tipo de tumor con Rituximab produce una tasa de respuesta alta, ofreciendo un perfil de toxicidad muy favorable. Cabe esperar una reducción del 90 % en el tamaño del tumor en 5–9 meses, con una tasa de remisión del 75–90 %.52
El médico responsable se enfrentaba a tres planes de manejo posibles para iniciar el tratamiento, que abordaban el tumor, el trombo flotante o la TVP iliofemoral. Debido a la posibilidad de que el tumor se redujera rápidamente con Rituximab, lo que podría dar lugar a la liberación del trombo y el consecuente riesgo de embolia pulmonar, el médico insertó un filtro recuperable en la vena cava inferior para administrar tratamiento trombolítico dirigido por un catéter iliofemoral. El tratamiento con Rituximab se inició tras la colocación del catéter, iniciándose el tratamiento con dobesilato de calcio para paliar el potencial de hipertensión venosa. Al cabo de dos semanas se resolvieron tanto la hinchazón en la ingle como el edema.
RESUMEN
La EVC genera una carga significativa sobre los servicios sanitarios y la sociedad en general. La fisiopatología de la EVC se origina por el aumento de la tensión venosa, el reflujo o la obstrucción, lo que da como resultado hipertensión venosa y una reducción del flujo sanguíneo. Estos factores inducen inflamaciones en la microcirculación y el consiguiente edema. El objetivo principal y común a todos los tratamientos es la mejora de los signos clínicos, de los síntomas y de la CdV del paciente. Los objetivos técnicos comunes, entre ellos la ablación del reflujo y la mejora de la función venosa, son ahora secundarios al alivio de los síntomas tanto para los pacientes como para los facultativos más actualizados. Técnicas invasivas y compresión actúan en torno al objetivo combinado de reducir los síntomas y resolver los mecanismos patológicos. Las intervenciones farmacológicas suponen una opción terapéutica complementaria que actúa sobre los síntomas y los mecanismos.
El dobesilato de calcio presenta una forma de acción singular sobre diversos objetivos que promueven la conservación de la integridad microvascular y la mejora de la circulación microvascular. El dobesilato de calcio tiene efectos específicos sobre la permeabilidad capilar y la reducción del edema; sin embargo, cuenta con efectos más amplios en los que se incluyen mecanismos de acción antiinflamatoria. El dobesilato de calcio mejora de forma efectiva los síntomas de la IVC y presenta buena tolerancia, con una baja incidencia de trastornos digestivos leves y reversibles. Por último, y lo que quizá sea de mayor importancia, el dobesilato de calcio mejora la CdV de los pacientes.







